犬尿氨酸通路和肿瘤进展
色氨酸代谢可抑制免疫细胞功能
色氨酸是人体产生的一种必需氨基酸,主要通过犬尿氨酸通路代谢,在调节不同免疫细胞类型的活动中发挥作用。1吲哚胺-2,3-双加氧酶(IDO1 或 IDO2)和色氨酸-2,3-双加氧酶 (TDO2) 是此通路中催化初始步骤和限速步骤的主要酶。这些酶将 L-色氨酸转化为 N-甲酰基-犬尿氨酸,然后进一步转化为犬尿氨酸。该过程会影响免疫系统:首先,通过去除局部微环境中的色氨酸,抑制 T 细胞的增殖和活性,2-5其次,通过产生犬尿氨酸,一种强效免疫调节分子,抑制 T 细胞和自然杀伤细胞的增殖和活性,并促进调节性 T 细胞的分化。6-9
吲哚胺-2,3-双加氧酶和色氨酸-2,3-双加氧酶由多种类型的细胞表达,包括基质细胞、血管细胞、肿瘤细胞和免疫细胞,特别是抗原呈递细胞。10此外,吲哚胺-2,3-双加氧酶的表达受到 IFN-γ、TNF-α 和 IL-6 等炎性分子的强力诱导,并且多种类型的肿瘤细胞均被证明能够表达吲哚胺-2,3-双加氧酶、色氨酸-2,3-双加氧酶或这两种酶。10-12 肿瘤细胞中吲哚胺-2,3-双加氧酶的表达水平高,与髓源抑制性细胞 (MDSC) 的扩增、募集和激活、肿瘤侵袭以及对免疫检查点阻断的抗性相关。13因此,免疫肿瘤学研究人员正在对犬尿氨酸通路特别是吲哚胺-2,3-双加氧酶的小分子抑制剂进行研究,并且有望开发出潜在的肿瘤免疫治疗药物。
Bio-Techne 提供一系列犬尿氨酸通路中的 R&D Systems 酶,以及其中部分酶的 Tocris® 小分子抑制剂,用于免疫肿瘤学研究。
犬尿氨酸通路酶 - 按分子分类的产品
犬尿氨酸通路的色氨酸代谢可抑制免疫细胞功能

肿瘤细胞或肿瘤微环境中的细胞高水平表达吲哚胺-2,3-双加氧酶和色氨酸-2,3-双加氧酶可抑制 T 细胞和自然杀伤 (NK) 细胞的功能。吲哚胺-2,3-双加氧酶和色氨酸-2,3-双加氧酶是参与色氨酸代谢的两种酶,由肿瘤细胞或肿瘤微环境中的其他细胞产生,包括肿瘤相关巨噬细胞 (TAM)、髓源抑制性细胞 (MDSC) 和抗原呈递细胞 (APC)。吲哚胺-2,3-双加氧酶和色氨酸-2,3-双加氧酶的高水平表达可加快色氨酸降解速度,导致肿瘤微环境中的色氨酸耗竭,并产生免疫抑制代谢物犬尿氨酸,从而创造出有利于肿瘤进展的环境。这些条件共同抑制 T 细胞和自然杀伤 (NK) 细胞的增殖和活性,并且促进调节性 T 细胞的生成。
比较 R&D Systems 重组人 IDO2 和竞争产品 IDO2 蛋白的酶活性
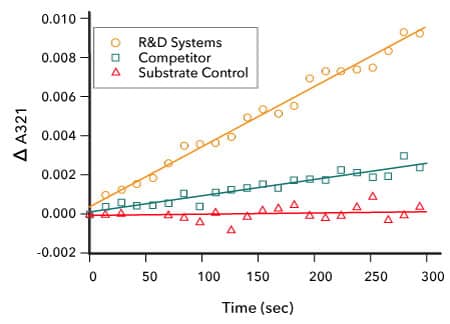
检测 IDO2 酶活性。通过检测重组人 IDO2 酶(R&D Systems,目录号 9967-AO)将 L-色氨酸氧化为 N-甲酰基-犬尿氨酸的能力来测定该酶的活性。发现 R&D Systems IDO2 酶(橙色)的活性大约是竞争产品 IDO2(绿色)的 4 倍。阴性对照显示为红色。
比较 R&D Systems 重组人 TDO2 和竞争产品 TDO2 蛋白的酶活性

检测 TDO2 酶活性。通过检测重组人 TDO2 酶 (R&D Systems,目录号 9768-TD)将 L-色氨酸氧化为 N-甲酰基-犬尿氨酸的能力来测定该酶的活性。发现 R&D Systems TDO2 酶(橙色)的活性大约是竞争产品 TDO2(绿色)的 10 倍。阴性对照显示为红色。
-
Erhardt, S. et al. (2009) Pharmacological manipulation of kynurenic acid: potential in the treatment of psychiatric disorders. CNS Drugs 23:91. PMID: 19173370.
-
Munn, D.H. et al. (1999) Inhibition of T cell proliferation by macrophage tryptophan catabolism. J. Exp. Med. 189:1363. PMID: 10224276.
-
Mellor, A.L. et al. (2002) Cells expression indoleamine 2,3-dioxygenase inhibit T cell responses. J. Immunol. 168:3771. PMID: 11937528.
-
Munn, D.H. & A.L. Mellor (2007) Indoleamine 2,3-dioxygenase and tumor-induced tolerance. J. Clin. Invest. 117:1147. PMID: 17476344.
-
Lee, G.K. et al. (2002) Tryptophan deprivation sensitizes activated T cells to apoptosis prior to cell division. Immunology 107:452. PMID: 12460190.
-
Frumento, G. et al. (2002) Tryptophan-derived catabolites are responsible for inhibition of T and natural killer cell proliferation induced by indoleamine 2,3-dioxygenase. J. Exp. Med. 196:459. PMID: 12186838.
-
Terness, P. et al. (2002) Inhibition of allogeneic T cell proliferation by indoleamine 2,3-dioxygenase-expressing dendritic cells: mediation of suppression by tryptophan metabolites. J. Exp. Med. 196:447. PMID: 12186837.
-
Della Chiesa, M. et al. (2006) The tryptophan catabolite L-kynurenine inhibits the surface expression of NKp46- and NKG2D-activating receptors and regulates NK-cell function. Blood 108:4118. PMID: 16902152.
-
Yan, Y. et al. (2010) IDO upregulates regulatory T cells via tryptophan catabolite and suppresses encephalitogenic T cell responses in experimental autoimmune encephalomyelitis. J. Immunol. 185:5953. PMID: 20944000.
-
Ye, Z. et al. (2019) Role of IDO and TDO in cancers and related diseases and the therapeutic implications. J. Cancer 10:2771. PMID: 31258785.
-
Marin-Acevedo, J.A. et al. (2018) Next generation of immune checkpoint therapy in cancer: new developments and challenges. J. Hematol. Oncol. 11:39. PMID: 29544515.
-
Burugu, S. et al. (2017) Emerging targets in cancer immunotherapy. Semin. Cancer Biol. 52:39. PMID: 28987965.
-
Holmgaard, R.B. et al. (2015) Tumor-expressed IDO recruits and activates MDSCs in a Treg-dependent manner. Cell Rep. 13:412. PMID: 26411680.