用于 CRISPR 基因编辑的特色产品
CRISPR-Cas9 基因编辑工作流程
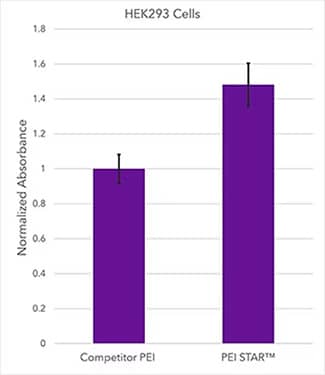
使用 PEI STAR™ 或竞品 PEI,用 CMV-SEAP 质粒转染的 HEK293 细胞悬液的吸光度读数。PEI STAR™ 转染试剂(目录号 7854)性能数据比较 (HEK293):使用 PEI STAR™ (3:1) 或主导性竞品 PEI,用 CMV-SEAP 质粒按优化的 PEI/DNA 比率转染含有 HEK293 悬液的 HEK 293 - 20 mL 培养物。SEAP 表达水平在转染后 5 天使用磷酸酶报告染料和 UV/Vis 吸光度定量。
基因转移效率
CRISPR-Cas9 抗体可以帮助验证基因转移是否成功。比较 Cas9 在转染的细胞与模拟转染的细胞中的表达对评估转染效率至关重要。借助 CRISPR-Cas9 抗体,您可以使用蛋白质印迹和/或免疫染色来验证转染效率。
CRISPR 介导的基因编辑通常为一个低效过程,可以使用小分子 CRISPR 增强剂来改进效率。
ii. CRISPR-Cas9 的检测
CRISPR-Cas9 的检测既涉及表达分析,也涉及确定细胞定位。可通过 CRISPR-Cas9 抗体实现对这些因素的分析。
CRISPR-Cas9 表达
Cas9 表达的水平以及持续时间对基于 CRISPR-Cas9 的基因组编辑至关重要。在稳定克隆中,高表达水平的 Cas9 可能导致非特异性活性。可通过分离多个克隆并借助蛋白质印迹分析筛选它们的 Cas9 表达水平,控制这种活性。对于瞬时转染,长期或延长的 Cas9 表达可能导致更多脱靶突变形成。CRISPR-Cas9 表达的瞬时性质可通过对不同时点收集的已转染样品进行蛋白质印迹分析来查验。
亚细胞定位
CRISPR-Cas9 必须转位至已转染细胞的胞核以执行其对 DNA 的影响。Cas9 的核定位可通过用 CRISPR-Cas9 抗体进行 ICC/IF 或 IHC 染色加以验证。
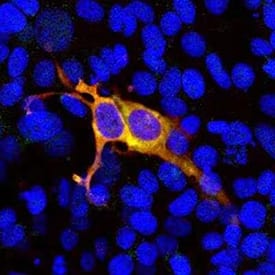
HEK293 细胞中 CRISPR-Cas9 的表达。将 HEK293 细胞用包含与 GFP 融合的化脓性链球菌 CRISPR-Cas9 N 端 608 个氨基酸的构建体转染,并用兔抗 CRISPR-Cas9 多克隆抗体(红色;目录号 NBP3-05548)染色。转染的细胞表达绿色融合蛋白,并结合处于红色的抗体,产生黄色信号。用蓝色 DNA 染液 DAPI 揭示已转染细胞和未转染细胞中的核 DNA。
iii. 编辑确认
确认靶细胞内部编辑成功是 CRISPR-Cas9 基因编辑工作流程中的一个重要步骤。编辑可以使用逆转录酶-聚合酶链反应 (RT-PCR) 在 mRNA 层面确认,或使用经敲除 (KO) 验证的抗体在基因层面确认。更多了解 CRISPR/Cas9 敲除裂解物
按应用划分的经敲除验证的抗体

对 K562 亲本细胞系和波形蛋白敲除 (KO) K562 细胞系中的波形蛋白表达进行蛋白质印迹分析。显示按 0.2 mg/mL 上样的 K562 亲本细胞系裂解物和波形蛋白敲除 (KO) K562 细胞系裂解物的蛋白质印迹分析。将膜用山羊抗人/小鼠/大鼠波形蛋白抗原亲和纯化的多克隆抗体(目录号 AF2105)探测,随后用 HRP 偶联抗山羊 IgG 二抗(目录号 HAF017)探测。一个特异性条带在亲本 K562 细胞系中约 55 kDa(如图中所示)处对波形蛋白检出,但在敲除 K562 细胞系中其不可检出。GAPDH (AF5718) 作为上样对照显示。
相关产品和服务
RNAscopeTM ISH 分析
RNAscopeTM ISH 分析
Bio-Techne 旗下品牌 Advanced Cell Diagnostics 提供 RNAScope ISH 技术,从而允许在单细胞层面可视化和在空间上检测 RNA,包括可用于 CRISPR-Cas9 检测的 Cas9 探针。
背景信息
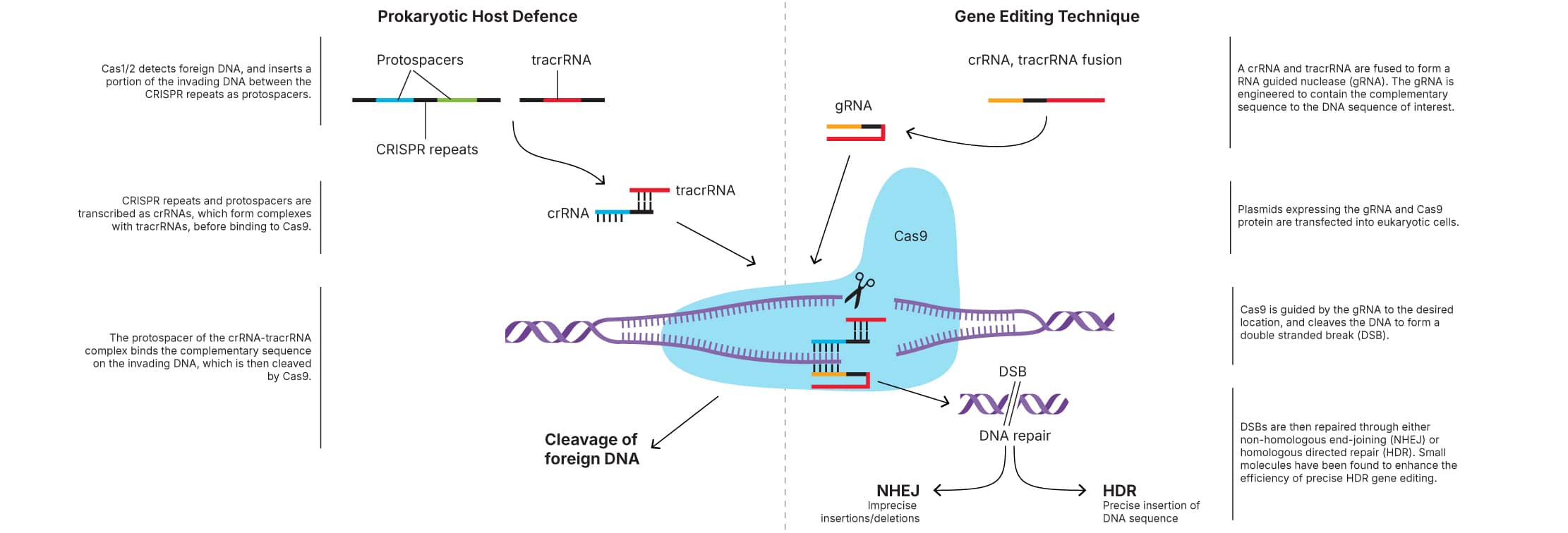
图 1:CRISPR-Cas 系统示意图。
CRISPR(成簇的规律间隔的短回文重复序列)是一种可应用于许多生物系统的基因定向编辑和调控技术。
CRISPR-Cas9 是一种 RNA 引导 DNA 核酸内切酶(分子量:158.4 kDa),是对抗侵入性质粒和病毒的获得性细菌免疫应答的组成部分。CRISPR 基因座由 Cas(CRISPR 关联)基因、前导序列和重复间隔区阵列(CRISPR 重复序列)组成。Cas 基因编码能够切割 DNA 的核酸酶。在 II 型 CRISPR 系统中,侵入性 DNA 为 Cas1/2 所探测,后者将一部分侵入性 DNA 插入细胞的 CRISPR 阵列中 CRISPR 重复序列之间,作为原间隔区。然后,CRISPR 阵列经转录以形成 crRNA,后者与反式激活性 (tra)crRNA 和 Cas9 形成复合体。之后,crRNA 的原间隔区部分与侵入性 DNA 上的互补序列结合,侵入性 DNA 为 Cas9 所切割。
已改编 CRISPR 系统以创立一项能够在基因组中特定位置进行基因定向编辑的技术。通过产生双链断口,CRISPR-Cas9 技术可用于在任何所需基因组位置诱导插入突变或缺失突变、特异性序列替换或插入以及巨型缺失或基因组重排。
通过设计 RNA 导引的核酸酶使之可能。在这些核酸酶的最简单形式下,Cas9 复合于导引 RNA (gRNA) ,后者由 crRNA 和 tracrRNA 组成。gRNA 含有与目的 DNA 序列互补的序列,因此导引 Cas9 至所需位置。之后,Cas9 切割 DNA 以产生 DSB。
可以借助内源性非同源末端连接 (NHEJ) 和同源性指导的修复过程 (HDR) 修复 DSB。借助 NHEJ 的 CRISPR-Cas9 介导基因组编辑过程不精确,但可以达到 20-60% 的效率,而借助 HDR 的基因编辑效率更精确,但已证明其仅达到 0.5-20%。由于 HDR 比 NHEJ 更精确,因此改进 HDR 的效率对 CRISPR-Cas9 系统用于众多应用中至关重要。
最近的研究已表明,小分子可以增进 HDR 介导基因编辑的效率。已经证明,β3 肾上腺素受体部分激动剂 L-755,507 在多能干细胞中增进 HDR 介导的 GFP 插入和点突变的效率分别达 3 倍和 9 倍。也已证明小分子 SCR7 吡嗪 增进 HDR 效率,增强 DNA 短片段插入高达 19 倍。增进 HDR 效率的小分子可能对应用 CRISPR-Cas9 基因编辑系统不可或缺。
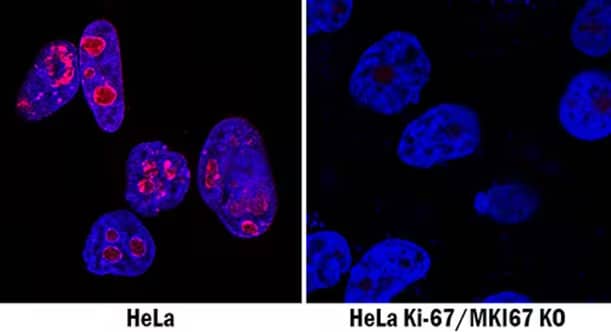
借助免疫细胞化学 (ICC) 验证人 Ki-67/MKI67 敲除 (KO) 抗体。
国际抗体验证工作组已提出使用基因阴性对照作为确保抗体特异性的五个关键标准之一。抗体-靶标相互作用的特异性、选择性和保真度通常根据特定分析性应用(例如免疫印迹与免疫染色)的复杂性而变动。双敲除性细胞裂解物(蛋白质印迹)和细胞系(免疫细胞化学)是快速、可靠证明抗体对目的靶标有特异性并确保重现性的理想阴性对照。
CRISPR/Cas9 基因编辑技术用于生成敲除细胞裂解物和细胞系确保了开发出验证抗体特异性和阐明基因功能的实用工具。例如,在蛋白质印迹分析中,抗体特异性的初始指标是在预期靶标大小处存在单一条带,然而,恰当的抗体验证要求使用充分的对照。由于 CRISPR/Cas9 基因编辑技术能够实现完全移除或“敲除”靶蛋白编码基因的两个等位基因,因此,通过证明在蛋白质印迹 (WB) 分析时蛋白质条带仅存在于野生型裂解物而不存在于 KO 细胞裂解物中,确认抗体特异性。
注:为了确认差异性表达,重要的是分析一种作为加载对照的单独靶蛋白(例如 GAPDH),以证明所有样品均跨各孔同等加载和转移。