TIM-3:新兴免疫肿瘤学靶标
TIM-3 是一种可与 Gal-9、CEACAM-1 和 HMGB1 结合的抑制受体
T 细胞免疫球蛋白黏蛋白 3 (TIM-3),也称为甲型肝炎病毒细胞受体 2 (HAVCR2),是 TIM 蛋白家族的成员,该家族包括人类中的 TIM-1、TIM-3 和 TIM-4 以及小鼠中的 TIM-1-8。1TIM 家族蛋白为 I 型跨膜糖蛋白,具有一个胞外结构域,该区域由 N 端 IgV 样结构域、黏蛋白样结构域和茎结构域组成,各自具有潜在的 O-连接糖基化和 N-连接糖基化位点。与胞外结构域相连的是跨膜片段,除了 TIM-4,所有 TIM 分子还有一个细胞质尾部,该部分具有包含五个酪氨酸残基的保守区域,这些残基对于下游信号转导至关重要。2,3TIM-3 在产生 IFN-γ 的 CD8+ T 细胞和 Th1 细胞上表达,同时也会在 Th17 细胞上少量表达,已有研究证明,其会负向调节 T 细胞增殖和细胞因子生成。1-6此外,TIM-3 还会在调节性 T 细胞亚群、树突状细胞 (DC)、巨噬细胞、单核细胞和肥大细胞上表达。7, 8与 PD-1 相似,在慢性感染和癌症中,它也会在耗竭 T 细胞和自然杀伤细胞上大量表达。9-12
研究表明,TIM-3 蛋白的 IgV 结构域可与四种不同的配体结合,包括半乳凝素-9、磷脂酰丝氨酸 (PtdSer)、高迁移率族蛋白 B1 (HMGB1) 以及癌胚抗原相关细胞粘附分子 1 (CEACAM-1)。13-18半乳凝素-9 是第一个被发现的 TIM-3 配体,它能与 TIM-3 IgV 结构域中的碳水化合物基序结合并诱导 Th1 细胞凋亡。13与半乳凝素-9(在 TIM-3 蛋白上有独特的结合位点)不同,其他 TIM-3 配体在 TIM-3 蛋白 IgV 结构域的 FG-CC’ 环区域内具有重叠的结合位点。3PtdSer 是一种暴露于凋亡细胞表面的分子,它不仅会与 TIM-3 结合,还会与 TIM-1 和 TIM-4 结合,同时与巨噬细胞和树突状细胞介导的凋亡细胞摄取和抗原交叉呈递有关。19HMGB1 是一种损伤相关分子,也已被证明会与 TIM-3 蛋白结合。16HMGB1 是由应激或濒死细胞释放的,在将核酸转运至核内体的过程中发挥作用,这是激活针对病原体和肿瘤的先天免疫应答所必需的。而 HMGB1 与 TIM-3 结合会干扰这一过程,从而抑制先天免疫和抗肿瘤免疫应答。最后,TIM-3 蛋白还会与 CEACAM-1 相互作用,并且已有研究证明,这两种蛋白之间的顺式相互作用对于 TIM-3 糖基化、稳定性及其抑制 T 细胞功能的能力来说,至关重要。3,17CEACAM-1 与 TIM-3 蛋白也可发生反式相互作用,从而负向调节 T 细胞应答。3
TIM-3 会在多种癌症的 CD8+ 肿瘤浸润淋巴细胞 (TIL) 和 CD4+ 调节性 T 细胞上大量表达。3, 7, 11, 20, 21所有 TIM-3+ CD8+ TIL 都会共同表达 PD-1,而在小鼠肿瘤模型和许多不同类型的人类癌症中,这类 T 细胞就是功能障碍最严重的那一群 CD8+ TIL。22研究表明,单独阻断 TIM-3 在不同小鼠肿瘤模型中具有不同的效果,但同时阻断 TIM-3 和 PD-1 可协同减弱肿瘤生长。9, 22-24通过联合阻断 TIM-3/PD-1 所观察到的积极抗肿瘤作用归结于耗竭 CD8+ TIL 功能的恢复(包括肿瘤抗原特异性 T 细胞增殖和细胞因子生成),以及对 TIM-3+ 调节性 T 细胞免疫抑制功能的抑制。此外,联合阻断 TIM-3/PD-1 通过恢复耗竭自然杀伤细胞的活性、抑制半乳凝素-9-TIM-3 介导的免疫抑制髓源性抑制细胞 (MDSC) 的扩增,和/或阻止瘤内 DC 上的 TIM-3 与 HMGB1 相互作用,可改善抗肿瘤免疫应答,从而恢复对肿瘤细胞来源核酸的先天免疫应答。25,26因此,靶向 TIM-3 和 PD-1(或 CTLA-4)的联合治疗,或靶向 TIM-3 并联用 T 细胞共刺激受体激动剂抗体的联合治疗,值得进一步探索。
Bio-Techne 提供了 TIM-3、半乳凝素-9、CEACAM-1 和 HMGB1 所对应的 R&D SystemsTM 生物活性重组蛋白,以及用于检测这些分子的荧光染料偶联抗体,以帮助我们进一步了解 TIM-3 及其配体的免疫抑制功能。
TIM-3 和 TIM-3 配体 - 按分子分类的产品
How Does Tim-3 Inhibit Immune Cell Functions?

TIM-3 通过作用于多种不同的免疫细胞来抑制免疫细胞功能。TIM-3 是一种可在多种造血细胞上表达的抑制受体。TIM-3 在 CD8+ T 细胞和自然杀伤细胞上的高水平表达与耗竭表型相关,而 TIM-3 在肿瘤相关的 FoxP3+ 调节性 T 细胞 (Treg) 上的表达,标志着 Treg 的一个亚群具有更强的抑制功能和恢复能力。TIM-3 可与四种不同的配体结合,包括半乳凝素-9 (Gal-9)、CEACAM-1、HMGB1 和磷脂酰丝氨酸 (PtdSer)。TIM-3 会在 Th1 细胞上表达,并且半乳凝素-9 与这些细胞上的 TIM-3 结合会诱导 Th1 细胞凋亡。Th1 细胞产生的 IFN-γ 上调了半乳凝素-9 的表达,这促进了髓源性抑制细胞 (MDSC) 的扩增。而 MDSC 可产生更多的半乳凝素-9,从而进一步促进 Th1 细胞凋亡和 CD8+ T 细胞耗竭。TIM-3 也可与 CEACAM-1 结合,这对于 TIM-3 糖基化、稳定性及其负向调节 T 细胞应答的能力来说,至关重要(左图)。此外,TIM-3 还可与损伤相关分子 HMGB1 相互作用,这可抑制 HMGB1 将肿瘤来源的核酸转运到肿瘤相关树突状细胞内的核内体中,从而影响抗肿瘤免疫应答的启动(右图)。最后,TIM-3 会与凋亡细胞上的 PtdSer 结合,并通过树突状细胞介导凋亡细胞摄取和抗原交叉呈递(右图)。目前尚不清楚这一相互作用会如何影响 TIM-3+ T 细胞。
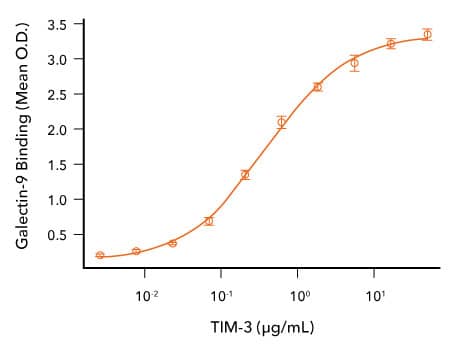
R&D Systems 重组人 Gal-9 与 TIM-3 蛋白的结合分析
R&D Systems 重组人 TIM-3 蛋白纯度评估
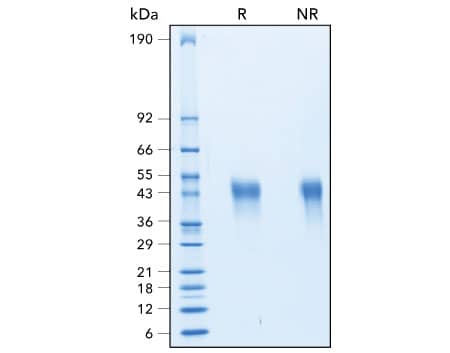
通过 SDS-PAGE 评估重组人 TIM-3 的纯度。通过 SDS-PAGE 分析,在还原 (R) 和非还原 (NR) 条件下评估了重组人 TIM-3(R&D Systems,目录号 10241-TI)的纯度,用考马斯蓝 (Coomassie® Blue) 染色来进行可视化。
R&D Systems 重组食蟹猴 TIM-3 蛋白生物活性分析
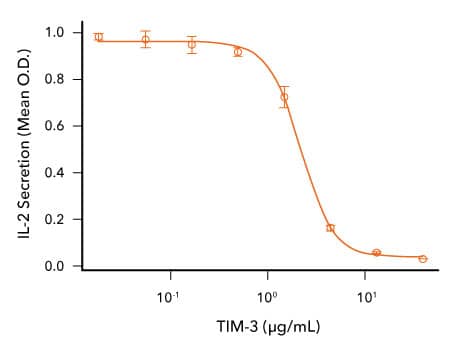
TIM-3 可抑制人 T 细胞中抗 CD3 诱导的 IL-2 分泌。用固定化小鼠抗人 CD3 ε 单克隆抗体(R&D Systems,目录号 MAB100;1μg/mL)和指定浓度的重组食蟹猴 TIM-3(R&D Systems,目录号 7914-TM)孵育人 T 细胞。使用人 IL-2 QuantikineTM ELISA 试剂盒(R&D Systems,目录号 D2050)测定细胞培养上清液中的 IL-2 分泌。这一作用的 ED50 通常为 0.5-3 μg/mL。
-
Freeman, G.J. et al. (2010) TIM genes: a family of cell surface phosphatidylserine receptors that regulate innate and adaptive immunity. Immunol. Rev. 235:172. PMID: 20536563.
-
Monney, L. et al. (2002) Th1-specific cell surface protein Tim-3 regulates macrophage activation and severity of an autoimmune disease. Nature 415:536. PMID: 11823861.
-
Das, M. et al. (2017) Tim-3 and its role in regulating anti-tumor immunity. Immunol. Rev. 276:97. PMID: 28258697.
-
Sanchez-Fueyo, A. et al. (2003) Tim-3 inhibits T helper type 1-mediated auto- and alloimmune responses and promotes immunological tolerance. Nat. Immunol. 4:1093. PMID: 14556005.
-
Hastings, W.D. et al. (2009) Tim-3 is expressed on activated human CD4+ T cells and regulates Th1 and Th17 cytokines. Eur. J. Immunol. 39:2492. PMID: 19676072.
-
Anderson, A.C. et al. (2016) Lag-3, Tim-3, and TIGIT: Co-inhibitory receptors with specialized functions in immune regulation. Immunity 44:989. PMID: 27192565.
-
Anderson, A.C. et al. (2007) Promotion of tissue inflammation by the immune receptor Tim-3 expressed on innate immune cells. Science 318:1141. PMID: 18006747.
-
Zhao, H. et al. (2017) Tregs: where we are and what comes next? Front. Immunol. 8:1578. PMID: 29225597.
-
Sakuishi, K. et al. (2013) Tim3+FoxP3+ regulatory T cells are tissue-specific promoters of T-cell dysfunction in cancer. Oncoimmunology 2:23849. PMID: 23734331.
-
Jones, R.B. et al. (2008) Tim-3 expression defines a novel population of dysfunctional T cells with highly elevated frequencies in progressive HIV-1 infection. J. Exp. Med. 205:2763. PMID: 19001139.
-
Sakuishi, K. et al. (2010) Targeting Tim-3 and PD-1 pathways to reverse T cell exhaustion and restore anti-tumor immunity. J. Exp. Med. 207:2187. PMID: 20819927.
-
Gallois, A. et al. (2014) Reversal of natural killer cell exhaustion by TIM-3 blockade. Oncoimmunology 3:946365. PMID: 25964857.
-
Zhu, C. et al. (2005) The Tim-3 ligand galectin-9 negatively regulates T helper type 1 immunity. Nat. Immunol. 6:1245. PMID: 16286920.
-
Cao, E. et al. (2007) T cell immunoglobulin mucin-3 crystal structure reveals a galectin-9-independent ligand-binding surface. Immunity 26:311. PMID: 17363302.
-
Bu, X. et al. (2010) T cell/transmembrane, Ig, and mucin-3 allelic variants differentially recognize phosphatidylserine and mediate phagocytosis of apoptotic cells. J. Immunol. 184:1918. PMID: 20083673.
-
Chiba, S. et al. (2012) Tumor-infiltrating DCs suppress nucleic acid-mediated innate immune responses through interactions between the receptor TIM-3 and the alarmin HMGB1. Nat. Immunol. 13:832. PMID: 22842346.
-
Huang, Y.H. et al. (2015) CEACAM1 regulates TIM-3-mediated tolerance and exhaustion. Nature 517:386. PMID: 25363763.
-
Sabatos-Peyton, C.A. et al. (2017) Blockade of Tim-3 to phosphatidylserine and CEACAM1 is a shared feature of anti-Tim-3 antibodies that have functional efficacy. Oncoimmunology 7:1385690. PMID: 29308307.
-
Nakayama, M. et al. (2009) Tim-3 mediates phagocytosis of apoptotic cells and cross-presentation. Blood 113:3821. PMID: 19224762.
-
Gao, X. et al. (2012) TIM-3 expression characterizes regulatory T cells in tumor tissues and is associated with lung cancer progression. PLoS One 7:30676. PMID: 22363469.
-
Sun, H. & C. Sun (2019) The rise of NK cell checkpoints as promising therapeutic targets in cancer immunotherapy. Front. Immunol. 10:2354. PMID: 31681269.
-
Anderson, A.C. (2014) Tim-3: An emerging target in the cancer immunotherapy landscape. Cancer Immunol. Res. 2:393. PMID: 24795351.
-
Ngiow, S.F. et al. (2011) Anti-TIM3 antibody promotes T cell IFN-gamma-mediated antitumor immunity and suppresses established tumors. Cancer Res. 71:3540. PMID: 21430066.
-
Koyama, S. et al. (2016) Adaptive resistance to therapeutic PD-1 blockade is associated with upregulation of alternative immune checkpoints. Nat. Commun. 7:10501. PMID: 26883990.
-
Du, W. et al. (2017) TIM-3 as a target for cancer immunotherapy and mechanisms of action. Int. J. Mol. Sci. 18:645. PMID: 28300768.
-
Dardalhon, V. et al. (2010) Tim-3/galectin-9 pathway: regulation of Th1 immunity through promotion of CD11b+Ly-6G+ myeloid cells. J. Immunol. 185:1383. PMID: 20574007.